(CNN) – La Administración de Alimentos y Medicamentos de EE.UU. (FDA, por sus siglas en inglés) aprobó este viernes dos tratamientos genéticos contra la anemia falciforme, incluido el primero que emplea la técnica de edición genética CRISPR, inaugurando así una nueva era en el tratamiento de enfermedades genéticas.
Los medicamentos, llamados Casgevy y Lyfgenia, son curas potenciales para personas con anemia falciforme, un trastorno hereditario de los glóbulos rojos que debilita y acorta la vida y afecta de forma desproporcionada a los estadounidenses negros.
Casgevy es el tratamiento basado en CRISPR, fabricado por Vertex Pharmaceuticals y Crispr Therapeutics, mientras que Lyfgenia, fabricado por Bluebird Bio, utiliza un enfoque de terapia génica más antiguo. Ambos han sido autorizados para personas mayores de 12 años con antecedentes de crisis vasooclusivas, episodios dolorosos causados por la enfermedad.
“La anemia falciforme es un trastorno sanguíneo raro, debilitante y potencialmente mortal con importantes necesidades no cubiertas”, declaró la Dra. Nicole Verdun, directora de la Oficina de Productos Terapéuticos de la FDA dentro de su Centro de Evaluación e Investigación Biológica. “Nos complace avanzar en este campo, especialmente para las personas cuyas vidas se han visto gravemente alteradas por la enfermedad, al aprobar hoy dos terapias génicas celulares”.
Casgevy costará US$ 2,2 millones por el tratamiento único, según informó Vertex en un documento regulatorio, mientras que Lyfgenia costará US$ 3,1 millones, según dijo Bluebird en un comunicado.
Un grupo de análisis de precios de medicamentos, el Institute for Clinical and Economic Review, había sugerido que un precio de entre US$ 1,35 y 2,05 millones para cada terapia los habría hecho rentables y animó a las empresas a considerar la fijación de precios de los medicamentos en el extremo inferior de ese rango para permitir un acceso más amplio.
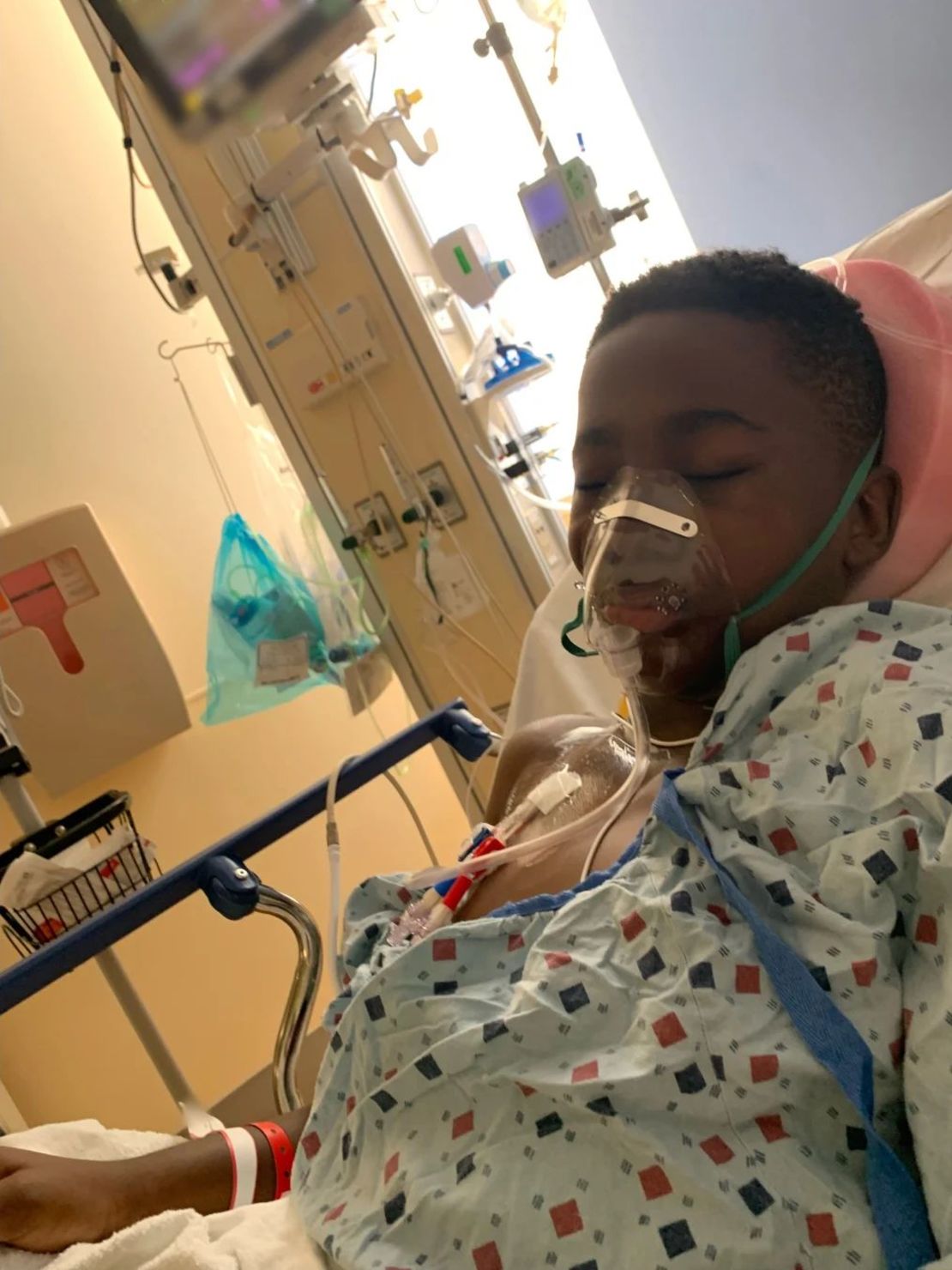
Johnny Lubin es una de las personas más jóvenes que se ha sometido al tratamiento CRISPR, como parte de un ensayo clínico. Antes de someterse a él, recuerda, tenía una preocupación principal.
“Me preocupaba que pudiera tener superpoderes”, dice Johnny, que ahora tiene 15 años y vive en Trumbull, Connecticut, a unos 100 kilómetros al norte de Nueva York.
Para muchos miembros de la comunidad de pacientes con anemia falciforme, las autorizaciones han tardado mucho en llegar. Según los Centros para el Control y la Prevención de Enfermedades (CDC) de EE.UU., esta enfermedad afecta a unas 100.000 personas en el país, de las que 1 de cada 365 es de raza negra, y la industria farmacéutica la considera desatendida desde hace tiempo. Se cree que unas 20.000 personas en EE.UU. padecen una forma lo bastante grave de la enfermedad como para poder optar a un tratamiento como éste.
“Que la anemia falciforme se convierta de repente en el centro de este nuevo y espectacular enfoque del desarrollo terapéutico es, por un lado, estupendo, porque cabe esperar que revierta parte de esa historia de abandono y preste la atención que siempre ha necesitado la comunidad de la anemia falciforme”, afirma Megan Allyse, bioeticista de la Clínica Mayo. Sin embargo, señala que el acceso a un tratamiento tan avanzado sigue siendo una cuestión importante.
La primera “enfermedad molecular”
Las bases de la anemia falciforme se conocen desde hace casi tres cuartos de siglo; en 1949, el químico Linus Pauling publicó un artículo en la revista Science en el que describía cómo la hemoglobina, proteína que transporta el oxígeno, es diferente en las personas con anemia falciforme, declarando esta dolencia la primera “enfermedad molecular”.
Eso fue cuatro años antes de que se propusiera la famosa estructura doble helicoidal del ADN.
“Llevábamos esperándolo desde que se descubrió el ADN”, afirma el Dr. Lewis Hsu, jefe médico de la Asociación Estadounidense de Anemia Falciforme (Sickle Cell Disease Association of America) y médico que trata a niños con anemia falciforme. “Ha tardado muchísimo en llegar”.
La anemia falciforme está causada por una mutación genética que hace que los glóbulos rojos, que contienen hemoglobina y transportan oxígeno por todo el cuerpo, estén deformados, como medias lunas u hoces. Estas células deformes pueden atascarse en los vasos sanguíneos, dañar los órganos y provocar episodios terribles de dolor que pueden durar días, denominados crisis vasooclusivas o de dolor.
“Me resultaba difícil hacer cosas como divertirme y demás, porque siempre tenía que estar preocupado por si iba a tener una crisis de dolor”, cuenta Johnny. El dolor “me afectaba sobre todo a la parte baja de la espalda, y siempre era como un dolor punzante… Me dolía mucho”.
Hasta ahora, la única esperanza de curación para las personas con anemia falciforme era un trasplante de médula ósea o células madre. Pero Johnny, como más del 80% de los pacientes con anemia falciforme, no pudo encontrar un donante compatible.
Durante los 13 primeros años de su vida, Johnny tuvo que ser hospitalizado cada pocos meses por crisis de dolor y otras complicaciones de la enfermedad. Sus padres tenían que abastecerse de analgésicos opiáceos y siempre llevaban consigo una “bolsa de viaje” por si necesitaban ir al hospital con poca anticipación.
Pero desde octubre de 2021, cuando Johnny recibió una única infusión de sus propias células genéticamente modificadas, no ha vuelto a sufrir ninguna crisis.
“Ha sido como un niño normal”, dijo la madre de Johnny, Fabienne Desir. “Nos ha cambiado la vida”.
Una nueva herramienta para editar genes
CRISPR es una técnica de edición de genes que permite a los científicos realizar cortes precisos en el ADN. El primer artículo científico sobre ella se publicó en 2012, y su desarrollo, por Jennifer Doudna y Emmanuelle Charpentier, ganó el Premio Nobel de Química solo ocho años después.
En el caso de la anemia falciforme, las células de los pacientes se extraen del cuerpo y se utiliza CRISPR para realizar una edición que vuelve a activar la producción de hemoglobina fetal, una forma de la proteína que los bebés producen en el útero. Una vez devueltas las células editadas, la hemoglobina fetal puede compensar la hemoglobina mutada que causa la anemia falciforme, explicó la Dra. Monica Bhatia, jefa de trasplante pediátrico de células madre del Centro Médico Irving de la Universidad de Columbia/Nueva York-Presbyterian, que ayudó a dirigir el ensayo en el que participó Johnny.
“Sabemos que la hemoglobina fetal tiene mayor capacidad de transporte de oxígeno que la hemoglobina adulta o la hemoglobina falciforme”, explica Bhatia.
Fabricar hemoglobina fetal junto con hemoglobina falciforme hace que un paciente sea similar a alguien con rasgo falciforme, explicó Bhatia; es decir, cuando alguien hereda un gen falciforme y otro normal, y “no tiene ninguna de las complicaciones de la enfermedad”, dijo. “Es más que suficiente”.
De hecho, el Dr. David Altshuler, director científico del fabricante de fármacos Vertex, señaló que algunas personas tienen de forma natural mutaciones genéticas que mantienen alta la hemoglobina fetal, “y no tienen síntomas, aunque padezcan la afección”.
“Así que era como un enfoque fisiológico demostrado que funcionaría si se pudiera activar la [hemoglobina] fetal”, dijo.
Los resultados de los ensayos clínicos, incluido el de Johnny, lo confirman. En los datos citados por la FDA antes de una reunión de la comisión asesora sobre el tratamiento en octubre, 29 de los 30 pacientes alcanzaron el objetivo principal del ensayo: ausencia de crisis de dolor durante al menos 12 meses después del tratamiento. El periodo más largo sin crisis fue de 45,5 meses, casi cuatro años, y los investigadores continuarán el seguimiento de los pacientes.
La esperanza es que los efectos puedan durar toda la vida.
“No tenemos tantos datos a largo plazo como en el caso del trasplante de células madre”, afirma Bhatia. “Pero esa sería la esperanza, que esto fuera comparable a un trasplante y que se mantuviera”.
Se esperaba que el segundo medicamento aprobado hoy, Lyfgenia, se aprobara pasadas unas semanas. Se trata de una tecnología más antigua, que utiliza un virus para administrar una copia sana del gen que produce la hemoglobina adulta para compensar la que produce la forma falciforme. También consiste en extraer las células del paciente de su cuerpo y luego devolvérselas. Los resultados son igualmente alentadores.
“Ambas técnicas aportan enormes beneficios a los pacientes”, declaró Andrew Obenshain, CEO de Bluebird.
Un precio de más de un millón de dólares
La cuestión clave es si la gente podrá costear y acceder a estos tratamientos. Los tratamientos genéticos únicos suelen costar más de un millón de dólares cada uno y requieren la infraestructura de grandes sistemas médicos.
“No sé si se cubrirán y pagarán”, afirma Hsu. Además, los centros médicos académicos que podrían ofrecer el tratamiento suelen estar en grandes ciudades.
“Yo estoy en Illinois, y básicamente se concentran en Chicago, lo que deja al resto del estado en una especie de vacío, por lo que la gente tendría que viajar una distancia muy larga para poder llegar a esto”, dijo. “Y en algunos estados no hay nada”.
Y el tratamiento no es sencillo. Requiere muchos cuidados adicionales que incrementan el costo. Los pacientes suelen permanecer en el hospital alrededor de un mes para prepararse para la reinfusión de células modificadas genéticamente, pasando primero por lo que se conoce como “acondicionamiento”: varios días de quimioterapia para eliminar su médula ósea, que produce células sanguíneas y plaquetas, de modo que estén preparados para recibir las nuevas células.
A continuación, “esas células tardan un tiempo en instalarse en la médula ósea y crecer”, explica Bhatia.
El periodo que rodea a la infusión puede ser muy difícil para los pacientes y sus familias. La madre de Johnny describió cómo “todo el tracto gastrointestinal de Johnny estaba inflamado; no podía tragar. Fue muy doloroso. Fue duro de ver”.
Hsu señaló que la quimioterapia conlleva riesgos, como la posibilidad de infertilidad. Señaló que existen métodos para intentar preservar la fertilidad antes del tratamiento, pero la cobertura para ello también puede variar según el estado. Y más de la mitad de las personas con anemia falciforme en EE.UU. dependen de Medicaid como seguro primario, según la organización Sick Cells.
El tratamiento de acondicionamiento también conlleva un riesgo potencial de cáncer. Dos pacientes de las primeras fases del ensayo de Bluebird murieron tras desarrollar leucemia, que se descubrió que no estaba relacionada con la terapia génica en sí, sino con la quimioterapia necesaria para prepararla.
Altshuler, de Vertex, dijo que su empresa está trabajando en la mejora del proceso de acondicionamiento para hacerlo menos agresivo, para “crear la oportunidad de que las nuevas células entren sin ningún otro daño para el cuerpo”, aunque señaló que todavía está en fase de investigación.
Los científicos también están atentos a los posibles efectos no deseados del método de edición genética CRISPR, es decir, que el ADN se corte en un lugar no previsto, y la FDA convocó una reunión de un día entero en octubre para evaluar esos riesgos. Muchos de los expertos allí presentes expresaron su confianza en que esos riesgos eran “relativamente pequeños”.
Para Altshuler, lo más importante de una aprobación de Casgevy es que exista un avance de este tipo para la anemia falciforme, no que sea la primera terapia CRISPR.
“No se trata de una herramienta, sino de la enfermedad”, afirma Altshuler. “Una vez que encontramos la forma de entrar, y ahora que hemos demostrado que se puede tratar esta enfermedad de forma muy eficaz si se puede aumentar la [hemoglobina] fetal, vamos a impulsar esto”.
Según Altshuler, la empresa se encuentra en las primeras fases de investigación sobre cómo aumentar la hemoglobina fetal mediante una píldora, de modo que los pacientes no tengan que pasar por el proceso de acondicionamiento y edición genética.
Señaló que es muy pronto, pero dijo que ese tipo de enfoque podría ser la respuesta a la “muy válida” pregunta de “¿cómo vamos a ayudar a la gente de todo el mundo con esta terapia?”.
La mayoría de los pacientes con anemia falciforme viven en África e India, y Obenshain, de Bluebird, dijo que la empresa no tiene planes de introducir allí “esta versión” de su terapia génica, señalando que es demasiado cara de fabricar.
“Básicamente, para cada paciente, fabricamos un lote de medicamento”, dijo Obenshain.
Para Johnny y su familia, los efectos de su tratamiento han sido tan transformadores que ahora celebran el día en que recibió la infusión de células modificadas genéticamente como su segundo cumpleaños. Puede ir a nadar sin miedo, una actividad que antes le provocaba una crisis de dolor, y pasó todo el verano pasado en la piscina, dice su familia.
Y aunque no obtuvo los superpoderes que le preocupaban, consiguió algo potencialmente aún mejor: la oportunidad de vivir una vida normal.
“Estoy empezando a enseñarle a conducir”, dice el padre de Johnny, JR Lubin. “Así que estamos entrando en la preocupación normal de, ya sabes, criar a un adolescente”.
