(CNN) – La vacuna contra el covid-19 de Moderna es segura y generó una respuesta inmunitaria en menores de 6 meses a 17 años que es comparable a la respuesta en adultos, según documentos publicados por la Administración de Alimentos y Medicamentos (FDA, por sus siglas en inglés) de EE.UU. antes de las reuniones clave de su grupo asesor independiente sobre vacunas.
Los asesores de vacunas de la FDA evaluarán la próxima semana que las vacunas contra el covid-19 de Moderna para niños de 6 meses a 5 años y de 6 años a 17 años deben recibir autorización de uso de emergencia.
Los niños menores de 5 años, alrededor de 18 millones de personas, son el único grupo de edad de Estados Unidos que aún no es elegible para recibir una vacuna contra el covid-19. La vacuna de Moderna actualmente está disponible solo para personas mayores de 18 años. La vacuna contra el covid-19 de Pfizer ya está autorizada para niños de 5 años en adelante. Los asesores de la FDA también evaluarán su vacuna para niños más pequeños la próxima semana.
Los documentos informativos publicados antes de las reuniones del comité de la FDA describen cómo se evaluó la vacuna de Moderna mediante estudios de inmunopuente para ver si la respuesta inmunitaria entre las personas más jóvenes era comparable a la de las personas de 18 a 25 años, que ya son elegibles para recibir la vacuna.
“Se cumplieron los criterios de éxito de inmunopuente para las cuatro cohortes de edad pediátrica”, indicó el documento de la FDA.
En ensayos que evaluaron a más de 6.000 niños de 6 meses a 6 años, Moderna descubrió que dos dosis de 25 microgramos de la vacuna tomadas con 28 días de diferencia produjeron una respuesta inmunitaria similar a una serie de dos dosis de la vacuna administrada a adolescentes de 18 a 25 años.
Para niños de 6 a 17 años, Moderna descubrió que dos dosis de su vacuna también proporcionó una respuesta inmune similar a la de dos dosis en adultos. Los niños de 6 a 11 años recibieron vacunas de 50 microgramos y los adolescentes de 12 a 17 años recibieron vacunas de 100 microgramos.
Estimaciones de eficacia
Los ensayos de la vacuna se llevaron a cabo en diferentes momentos, cuando circulaban diferentes variantes de coronavirus. Si bien la FDA no exigió a los fabricantes de vacunas que presentaran datos de eficacia de la vacuna para su autorización, se estimó que la vacuna de Moderna tenía una efectividad del 93,3 % contra la enfermedad sintomática en niños de 12 a 17 años durante una época en la que el coronavirus original y la variante Alfa estaban dominantes. Se estimó que la vacuna tenía una eficacia del 76,8 % contra el covid-19 sintomático para niños de 6 a 11 años durante un tiempo en el que predominaba la variante delta. Sin embargo, la FDA también señaló que para los niños de 6 a 11 años “no se pudo determinar de manera confiable la eficacia de la vacuna debido a la pequeña cantidad de casos de covid-19 acumulados durante el estudio”.
La vacuna se probó en niños de 6 meses a 5 años durante un tiempo en que la variante ómicron era dominante. Se estimó que tenía una eficacia del 36,8 % contra la enfermedad sintomática en niños de 2 a 5 años y una protección del 50,6 % contra la enfermedad sintomática en niños de 6 a 23 meses.
Las estimaciones de eficacia de la vacuna “para cada cohorte de edad fueron generalmente consistentes” con lo que se ha observado en adultos, dijo la FDA.
Seguridad de las vacunas
También se encontró que la vacuna era segura en todos los grupos de edad. Las reacciones adversas fueron “en su mayoría de gravedad leve a moderada, generalmente de corta duración y ocurrieron con más frecuencia… después de la dosis 2 que de la dosis 1”.
El dolor en el lugar de la inyección fue la reacción adversa más comúnmente informada y el documento decía que los eventos adversos graves eran poco frecuentes y no planteaban ninguna preocupación. No se reportaron muertes.
Si bien no hubo casos conocidos de miocarditis o pedicarditis (inflamación del corazón) entre los participantes del ensayo, es uno de los riesgos conocidos de la vacuna de Moderna contra el covid-19, especialmente entre los hombres de 18 a 24 años.
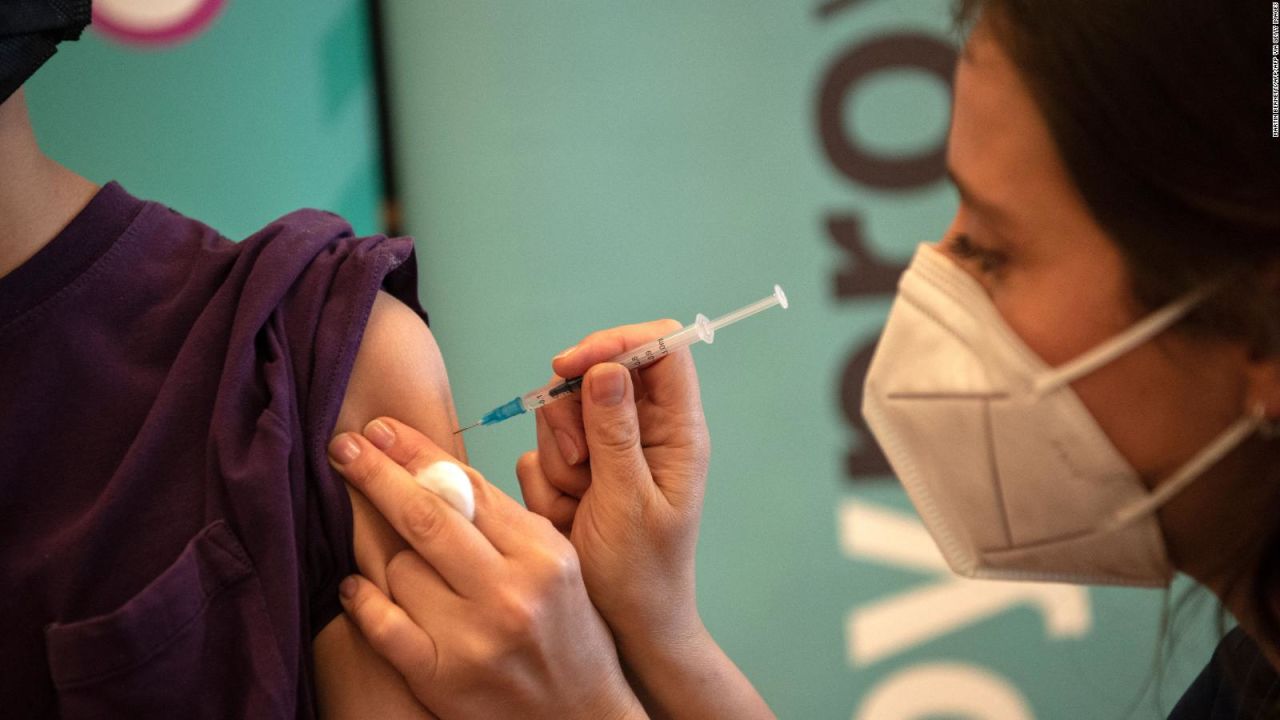
¿Qué sigue para la vacuna de Moderna?
La reunión del Comité Asesor de Vacunas y Productos Biológicos Relacionados de la FDA evaluará las vacunas contra el covid-19 de Moderna para niños de 6 a 17 años el 14 de junio y evaluará las vacunas contra el covid-19 de Moderna para niños de 6 meses a 5 años el 15 de junio.
La vacuna contra el covid-19 de Pfizer para niños menores de 5 años también se discutirá el 15 de junio.
Después de la votación de los asesores de vacunas de la FDA, la agencia debe decidir si autoriza las vacunas. Las inyecciones no se pueden administrar hasta que los asesores de vacunas de los Centros para el Control y la Prevención de Enfermedades de EE.UU. hayan votado si recomiendan las vacunas y el director de los CDC haya aprobado la recomendación. La Casa Blanca ha dicho que las vacunas para el grupo de edad más joven podrían administrarse a partir de la semana del 20 de junio.
